D'où vient le mégacolon, au travers des généalogiesOn parle beaucoup de mégacôlon ces temps-ci. Si tout le monde sait qu’il s’agit d’une maladie héréditaire très grave, il n’est pas forcément aisé de suivre les débats autour du sujet. Le principal point discuté est de savoir comment empêcher cette maladie de se propager et donc, plus concrètement, comment déterminer si un rat est porteur ou non de la maladie, lorsqu’on veut faire reproduire ce rat.
1 - Qu'es-ce que le mégacolon ?article destiné au grand publicLe mégacôlon est une dilatation excessive et définitive, sans accroissement de longueur, du côlon et du gros intestin. Cette maladie entraîne une constipation due à une accumulation des selles dans le côlon, provoquant douleurs, gonflements, occlusion et, finalement, la mort.
Le mégacôlon peut être d’origine congénitale ou acquise. Dans le premier cas, la maladie est présente depuis la naissance. Dans le second, elle est la conséquence d’une autre maladie (comme l’infection du côlon par exemple).
Chez l’humain, la maladie de Hirschsprung est la forme la plus classique de mégacôlon congénital. Mais il peut aussi être lié à d'autres maladies génétiques, c’est-à-dire que si ces maladies se déclarent, le mégacôlon peut aussi apparaître (syndrome de Bardet-Biedl, Chondrodysplasie métaphysaire autosomique récessive, Syndrome d'Ondine, Dysautonomie familiale, Syndrome de Mowat-Wilson, Pseudo-obstruction intestinale chronique idiopathique, Syndrome de Goldberg-Shprintzen, Néoplasie endocrinienne multiple type 2, etc.).
Cette maladie touche les mammifères, comme le chat, le chien, le cheval, la souris et, bien sûr, le rat.
Chez le ratLe mégacôlon acquis est une pathologie qui obstrue les contenus intestinaux et empêche le mouvement, ce qui résulte dans une dilatation extrême du côlon. Il peut être observé suite à des obstructions mécaniques, des dommages à la moelle épinière, des tumeurs, des maladies inflammatoires, et lors de réponses comme des abcès.
Le mégacôlon congénital est similaire à la maladie de Hirschsprung chez l’humain. Les cellules ganglionnaires entériques sont absentes ou n’arrivent pas à développer le plexus myentérique de la région rectosigmoïdienne du gros intestin (côlon). Cela a pour conséquence la réduction, ou l’absence complète, de mouvement péristaltique ou de réflexe de défécation dans le gros intestin, et l’incapacité de déplacer les matières fécales le long du côlon.
Dans le cas du mégacôlon congénital, les ganglions du nerf autonomique du muscle lisse du côlon sont absents. Cela peut impliquer soit un segment limité du côlon, soit tout le côlon. Le segment touché devient plus étroit, contient des restrictions, et est contracté de manière permanente. L’intestin proximal à ce segment est à la fois hypertrophié et dilaté. La relaxation interne normale du muscle sphincter qui se produit avec la distension rectale est absente, et au lieu que le sphincter se relâche, il se contracte. Comme les selles ne passent pas, ce qui entraine la dilatation de l’intestin, une distension abdominale se produit. Cette pression grandissante de l’intestin, et la résistance à l’étirement de la paroi rectale, résulte en une diminution du débit sanguin dans cette région, ainsi qu’en une détérioration de la barrière mucosale. Parce que les selles ne peuvent pas passer à travers l’intestin, une stase se produit et la croissance bactérienne conduit à une entérocolite et à une septicité résultante.
Le mégacôlon congénital résulte du développement défectueux des cellules de la crête neurale au stage embryonnaire. Les défauts dans les mélanocytes dérivés de la crête neurale, responsables des zones de poils blancs, et les défauts dans les neurones périphériques, responsables de l’absence de ganglions dans le tube digestif, se produisent sur le même chemin de migration.
C’est pourquoi on verra souvent le mégacôlon congénital apparaître chez des rats possédant certaines caractéristiques particulières, ceux dits de la lignée « high white ».
Symptômes· Dilatation abdominale
· Retard de croissance
· Selles retardées ou arrêtées
· Gonflements
· Constipation
· Diarrhée (habituellement avec mauvaise odeur)
· Diarrhée entrecoupée de périodes de constipation
· Matière fécale compactée visible dans le rectum
· Selles de forme inhabituelle (larges, incomplètes, cylindriques…)
Déclaration du mégacôlonLe mégacôlon peut se déclarer tôt ou tard (en ce cas, il est dit retardé).
Avec le mégacôlon se déclarant tôt, les signes apparaissent généralement dès que le raton commence à manger de la nourriture solide (aux environs de deux semaines) bien que parfois la maladie ne soit pas apparente et que les premiers problèmes n’apparaissent qu’à l’âge de 3 ou 4 semaines. Certains ratons présenteront un retard de croissance visible, alors qu’ils mangent bien. Cela est du à l’absence d’absorption correcte des nutriments dans le tube digestive endommagé. Les signes d’un mégacôlon se déclarant tôt, tels que les gonflements, la diarrhée, et une constipation grave, sont typiques de l’avancement rapide de la maladie. Il est recommandé de considérer l’euthanasie plutôt que de laisser la maladie suivre sa course vers une mort certaine.
Le mégacôlon se déclarant tardivement semble avoir la même origine génétique que le mégacôlon se déclarant tôt, et s’observe dans les mêmes lignées de rats. Il pourrait s’agir d’une forme atténuée de la maladie, mais malheureusement elle progresse en gravité jusqu’à devenir mortelle. Souvent, le premier signe de mégacôlon se déclarant tardivement s’observe dans le fait que le raton ne se développe pas. Les problèmes gastro-intestinaux peuvent ne pas devenir apparents jusqu’à ce que le rat ait entre 2 et 6 mois. A ce moment-là, on peut observer de gonflements, de la diarrhée, de la constipation, ou des périodes alternées de diarrhée et de constipation. Les selles qui arrivent à passer peuvent être dures, fibreuses, avoir une mauvaise odeur, être sèches, surdimensionnées, de forme inhabituelle, plates aux extrémités, et avoir du sans ou du mucus dedans ou entre elles.
Les déclarations tardives peuvent aussi être encore plus retardées, la maladie ne devenant pas symptomatique jusqu’à ce que le rat ait atteint l’âge de 4-10 mois. Sans la présence de signes avertisseurs précoces d’un problème (comme le retard de croissance, les selles inhabituelles, ou la diarrhée chronique), le type « très tardif » peut souvent être trop avancé, lorsque le problème devient apparent, pour être traité.
DiagnosticLes premiers signes sont la malnutrition et l’incapacité à grandir pour le raton. Puis, il y a la dilatation et l’absence de selles dans le rectum. A l’examen radiologique, des boucles remplies de gaz et de fluides peuvent être visualisées. Le raton peut présenter une entérocolite, qui s’observe par une diarrhée contenant du sang, une déshydratation, une perforation, un abcès péricolique, et une septicémie.
TraitementLe taux de mortalité chez les rats présentant cette maladie à la naissance ou peu de temps après est très élevée. L’euthanasie peut être nécessaire.
Les rats qui survivent après la période de l’enfance auront besoin d’un traitement à vie. Bien que la qualité de vie puisse être maintenue, l’espérance de vie peut être réduite. Alors que chez les mammifères plus grands, on peut opérer pour retirer les parties du côlon qui sont endommagées, ce n’est actuellement pas une option pour les rats. En effet, si on peut retirer la partie endommagée du côlon, on ne peut pas « refaire un raccord » après, parce que le côlon est trop petit.
2 - Ce que l'on sait, ce que l'on croit et ce que l'on ne sait pasarticle destiné au grand publicRelation entre la couleur blanche et le mégacôlonChez l’embryon, les cellules neurales proviennent en une bande le long du dos (appelée la crête neurale) et migrent depuis là vers le reste du corps pendant le développement. Les cellules de pigment sont en fait une sous-partie de ces cellules neurales. Beaucoup de cellules neurales font cette migration, comme celles qui innervent le côlon, et celles qui vont dans l’oreille interne.

Migration des cellules neurales depuis la crête neurale chez l’embryon du rat après 18 jours (dessin adapté de Wendt-Wagener 1961)
Si cette migration de cellules est retardée, alors ces cellules peuvent ne pas atteindre leur destination. Alors, il peut y avoir des zones dépigmentées (blanches) sur le corps, en particulier dans les régions éloignées du dos, comme la tête, les iris, les pieds, le ventre, le bout de la queue etc., bien que la dépigmentation puisse aussi être étendue.
Un retard dans la migration des cellules neurales signifie que l’extrémité du côlon peut ne pas être innervée, ce qui signifie que l’animal ne peut pas contrôler son côlon correctement, résultant en un mégacôlon.
Les cellules de la crête neurale migrent également vers l’oreille interne, où elles sont importantes pour entendre. C’est pourquoi une mutation dans la migration des cellules peut parfois résulter en des taches blanches et la surdité (par exemple chez les chats et les chiens).
La migration des cellules est un processus complexe ayant de nombreuses étapes, et il y a de nombreuses façons différentes dont elle peut mal se passer. Par exemple, les cellules migrantes suivent des « panneaux de signalisation » moléculaires qui leur indiquent où aller dans le corps. Une mutation dans ces indicateurs, ou dans les récepteurs des cellules migrantes qui sont supposées « lire » ces indicateurs, peut influencer la migration.
Les rats ne sont pas les seuls animaux dont les mutations affectant la migration des cellules neurales entraînent une absence de pigmentation (des poils blancs) et des problèmes de côlon et d’ouïe.
De nombreux autres animaux sont aussi affectés par ces mutations, et chaque mutation entraîne tout un tas de différents symptômes liés…
· Chez les chevaux : les poulains de type overo (blanc ou majoritairement blanc) peuvent développer le « syndrome létal du poulain blanc » qui entraine la mort par mégacôlon quelques heures ou quelques jours seulement après la naissance.
· Chez les humains : toupet blanc, yeux vairons, surdité et mégacôlon forment le « syndrome de Waardenburg de Type 4 » ou « Waardenburg-Shah ».
· Chez les furets : surdité et tête blanche (également appelé « Waardenburg »).
· Chez les chiens et les chats : surdité et pelage blanc (comme chez de nombreux dalmatiens).
Tous ces effets sont dus à des mutations dans le processus de migration des cellules depuis la crête neurale pendant l’embryogénèse.
Les mutations trouvées chez ces différentes espèces peuvent ne pas être des mutations identiques, et la même espèce peut avoir différentes sortes de mutations qui affectent ce chemin développemental, mais elles affectent tous les même processus commun sous-jacent.
Cette maladie peut donc, théoriquement, toucher n'importe quel rat. Cependant, la forme la plus courante est héréditaire et multifactorielle, c’est-à-dire qu’elle dépend de plusieurs facteurs. Dans ce cas, la maladie se déclare dans les premières semaines de la vie du rat qui porte la maladie et qui possède un « terrain favorable » (qui est apparemment lié à certains marquages et couleurs, et d’autres caractéristiques physiques comme les yeux vairons, et peut-être également à d’autres maladies).
3. Méthode de transmissionOn ne sait pas encore exactement comment le mégacôlon se transmet. Cependant, les études des généalogies touchées montrent qu'il y a eu une transmission héréditaire.
On sait que le mégacôlon peut :
- sauter jusqu'à 15 générations sans se déclarer ;
- toucher une partie ou 100% de la portée.
La méthode de transmission génétique de la maladie ne suit pas une disposition génétique typique et il y a plusieurs variations de gènes. Les gènes responsables semblent impliquer des modes polygénétiques (multifactoriels) de transmission. La transmission multifactorielle rend virtuellement impossible de prédire le résultat de la reproduction de rats qui sont, ou semblent être, à haut risque par rapport au mégacôlon. Il a été noté observé que les modes multifactoriels de transmission impliquant le mégacôlon on un « léger » risque. Dans les cas où le mégacôlon est grave et/ou plusieurs ratons de la même portée sont touchés, alors on pense que la transmission génétique va augmenter.
On ne sait pas actuellement si le gène responsable du mégacôlon est récessif et dominant.
Officiellement, on considère, en France, que le mégacolon ne se déclare que chez les rats dits high white. C’est ce qu’on appelle le « terrain favorable ». On a également conclu que si ce gène était absent, le rat pouvait porter la maladie, mais pas l’exprimer.
En suivant cette idée, certains on pensé que si un rat est high white mais qu’il ne déclare pas le mégacôlon, cela veut dire qu’il ne porte pas le mégacôlon est donc que la lignée est saine. Toutefois, ceci n’est qu’une hypothèse qui n’a pas été prouvée scientifiquement. La seule chose dont on peut être relativement sûr, c’est qu’il y a un lien entre high white et mégacôlon.
Il est toutefois important de noter que le mégacôlon peut être causé par d’autres facteurs. Tous les rats « blazed » ne développent pas le mégacôlon et le mégacôlon peut se déclarer chez des rats qui ne sont pas « blazed ».
Il semblerait que certains marquages que l'on a identifiés comme étant liés au gène high white ne le soient en fait pas forcément. En effet, ces marquages pourraient être issus d’une mutation différente, qui résulterait dans une apparence similaire. Il y aurait donc des rats BEW porteurs du gène high white, et d’autres non. Autrement dit, des rats BEW qui ne peuvent qu’exprimer (théoriquement) le mégacôlon et d’autres qui ne peuvent que le porter.
La question suivante qui pourrait se poser est donc : peut-on avoir des rats à petit marquage qui n’aient pas le gène high white ? Parce que si c'est le cas, alors il est certain qu'on ne peut « innocenter » aucun rat, c’est-à-dire le déclarer non-porteur.
Il serait intéressant de comprendre en plus comment le mégacôlon peut se déclarer chez un rat « variegated down-under noir dumbo lisse (yeux noirs) » qui, d'après ses yeux et son marquage, n'est pas censé avoir le gène high white - ce qui compliquerait encore davantage l'innocentage des rats.
Chez l’humain, la maladie de Hirschsprung (proche du mégacôlon du rat) peut être soit de type 1 de forme dominante, soit de type 2 de forme récessive (donc existant sous les 2 formes).
La maladie de Hirschsprung peut être "comportée" par une autre maladie génétique telle que : le Syndrome de Bardet-Biedl, le Syndrome d'Ondine, Syndrome de Mowat-Wilson (dont certains des symptômes sont : petites tailles et épilepsies), Syndrome de Smith-Lemli-Opitz, etc, etc, etc. Certaines de ces maladies sont elles-mêmes récessives et d'autres sont dominantes !
Notons encore que chez l'humain, le mégacôlon met "longtemps" à tuer et qu'il peut être soigné, donc certains symptômes qui montrent la présence d'une autre maladie ont le temps de se déclarer (et en plus ... chez un humain, ça peut être testé, ce genre de chose). Est-ce que les rats épileptiques (un exemple parmi tant d'autres) ont des crises dès les premiers mois de leurs vies ? Je n'en suis pas sure.
Pour les forums, officiellement, le mégacôlon serait transmis par un seul des deux parents, et transmis à 50% des ratons. Le "terrain favorable" serait uniquement le high white. Toutefois, ces facteurs restent des hypothèses non-vérifiées.
Pour déterminer le niveau de risque d’une reproduction, il faut donc choisir des valeurs pour ces facteurs, en se basant sur l’observation et l’expérience, puisque l’influence réelle de ces facteurs n’est pas connue :
- Nombre de parents porteurs
- Taux de transmission parent-enfant
- Gène(s) directement liés
FacteursLe mégacôlon congénital apparait souvent chez des rats possédant certaines caractéristiques physiques, comme, par exemple :
· BEW (black.eyed white, c’est-à-dire blanc aux yeux noirs)
· Husky
· Blazed
· Split-capped
· Tei-colored
· Odd-eyed (yeux vairons)
· marquage masqué
· marquage patché
· Etc.
Ces caractéristiques ont toutes un point commun, c'est qu'elles apparaissent chez des rats qui possèdent le gène dit « high white ». Comme le mégacôlon apparaît plus souvent chez ces rats, il semble y avoir un lien entre l’apparition du mégacôlon et ce gène.
Toutefois, tous les marquages présentant du blanc ne sont pas « high white ». En effet, il existe de nombreux gènes différents responsables des marquages blancs chez les rats.
Il y a les gènes sur le locus « hooding » qui est également appelé le locus « white spotting » ou locus H. Ainsi, on va trouver du HH (rats unis), du Hh (rats berkshire), du hh (rats hooded) et tous les modificateurs de ces gènes responsables des marquages irish, bareback, capé, masqué, etc. Ils incluent les marquages dalmatien et variegated et les modificateurs à ces marquages. On pense que ce(s) gène(s), que l’on appelle « high white », et qui augmente selon toute probabilité le risque de mégacôlon, n’est pas présent ici. Il ne faut pas confondre le « high white » avec le dalmatien, le variegated, le roan, l’essex, le downunder (aussi appelé DU), ou tout autre gène de marquage. Le « high white » ne fait référence qu’au(x) gène(s) qui augmentent le risque de mégacôlon. Les gènes du locus H ne semblent pas augmenter ce risque.
Un marquage commun qui apparaît chez les rats high white est le « blaze ». Tous les rats « blazed » ne sont pas des rats high white, mais la majorité le sont car il s’agit d’un marquage dominant (certains types de blaze sont récessifs, mais c’est beaucoup moins courant). Les rats portant du blaze dominant sont donc high white ; ils ne portent pas tous le blaze en « coin », certains ont la marque en forme d’éclair, ou encore une marque asymétrique.
Le blaze dominant ne devrait pas être le seul marquage auquel il faut faire attention. « High white » signifie que des marquages blancs sont présents à des endroits où il est rare d’en voir. Par exemple, un rat berkshire a de la couleur sur le dos et les côtés (la tête, les pattes presque jusqu’en bas, etc.), et il a du blanc sur le ventre. Ce marquage blanc ne provient pas d’un gène high white ; il provient du marquage sur le locus H (dans ce cas, Hh). Lorsqu’un rat a du blanc qui remonte plus sur les côtés que le marquage normal, par contre, c’est un signe que le rat pourrait en fait être high white. Ces rats sont parfois appelés « à bande », car la couleur forme une bande sur le dos, et ce marquage provient en général d’un gène high white qui modifie le marquage berkshire ; ces rats peuvent ou non avoir un blaze.
Le high white peut faire apparaître des marquages blancs à d’autres endroits où ils devraient susciter de la suspicion, comme lorsque la bande du dos est interrompue sur la nuque (marquage loupé), ou si un rat est entièrement blanc, à part une tache de couleur sur la tête.
Un autre signe qui indique un risque élevé de mégacôlon sont les yeux vairons. Si un rat a les yeux vairons (donc de deux couleurs différentes), il est presque certain qu’il a un ou des gène(s) high white, car cette particularité est un des effets qui apparaît parfois chez els rats high white, et non un gène séparé.
Bien sûr, l’apparence physique d’un rat ne donne pas toutes les informations. Mais c’est un début. Par exemple, une tache de couleur sur la tête d’un rat blanc est un signe que le rat est probablement high white.
Faits vs hypothèsesIl y a souvent un amalgame qui est fait entre ce que l’on sait de manière certaine (les faits) et ce que l’on pense probable (les hypothèses).
| Les faits | Les hypothèses |
- sous sa forme congénitale, la maladie est héréditaire
- la maladie peut se transmettre sur plusieurs générations sans se déclarer
- la maladie est liée à certains gènes (high white)
| - on ne connait pas la méthode de transmission de la maladie
- on ne sait pas si le gène est récessif ou dominant
- on ne sait pas dans quelle mesure le gène high white influence l’apparition de la maladie
- on ne sait pas si la maladie n’a besoin que d’un seul parent, ou des deux, pour se transmettre
- on ne sait pas dans quelle mesure le parent transmet son risque à l’enfant
- on ne sait pas si, et dans quelle mesure, d’autres maladies représentent des facteurs favorables
|
Hors, pour déterminer le risque, il faut pouvoir quantifier ces facteurs pour lesquels on n’a pas de certitudes, et seulement des hypothèses. Au vu du nombre d’inconnues, il n’est pas possible, à l’heure actuelle, de déterminer avec certitude qu’un rat est parfaitement sain.
Les différentes possibilités dans le choix des facteurs influe donc le calcul du risque, ce qui explique que, selon la méthode, un même rat n’aura, au final, pas le même risque de transmettre la maladie à ses enfants.
Exemple de calcul 1Une méthode couramment employée utilise les hypothèses suivantes :
- Un seul parent porteur suffit à transmettre la maladie
- Le parent porteur transmet son risque à son enfant à 50%
- les rats high white représentent un terrain favorable, nécessaire à la déclaration de la maladie
 Exemple de calcul 1
Exemple de calcul 1Prenons un cas fictif. Pour déterminer le risque du rat Bidule (en bleu), c’est-à-dire la probabilité qu’il ait la maladie, on part du rat le plus proche dans sa généalogie, qui a déclaré la maladie, Ramalade (en rose). Depuis Ramalade, on remonte vers le « nœud », c’est-à-dire l’ancêtre commun qui relie Ramalade à Bidule, en passant par les parents. Dans notre cas, le nœud est Granny (en vert).
Ramalade a un risque de 1 (ou 100%) puisqu’il a déclaré la maladie. Avec l’hypothèse que seul un parent peut avoir transmis la maladie à Ramalade, chacun de ses parents ont un risque à 1/2 (ou 50%) d’être porteur.
A partir du nœud (Granny), il va falloir redescendre vers Bidule. Avec l’hypothèse qu’un parent passe son risque à seulement 50%, le risque est divisé par deux à chaque portée.
Donc, dans cet exemple, la probabilité que Bidule soit malade est de 1/16.
Exemple de calcul 2Prenons maintenant une méthode utilisant d’autres hypothèses :
- Un seul parent porteur suffit à transmettre la maladie
- Le parent porteur transmet son risque à son enfant à 100%
 Exemple de calcul 2
Exemple de calcul 2Sur le cas fictif utilisé auparavant, on utilise la même méthode pour déterminer le risque du rat Bidule. La différence est que cette fois, l’hypothèse est qu’un parent passe son risque à 100%, donc le risque n’est pas divisé par deux à chaque portée.
Avec cette méthode de calcul, la probabilité que Bidule soit malade est de 1/4.
Il y a donc une différence importante entre les deux calculs, puisque dans le premier cas, Bidule a 1/16 d’avoir la maladie, alors que dans le deuxième cas, il a seulement 1/4.
Le premier cas soutient la théorie que si, après 6 générations, la maladie ne se déclare pas, on a risque négligeable de voir la maladie se déclarer. En effet, avec cette méthode de calcul, le risque diminue très rapidement.
Hors, dans la réalité, on retrouve des cas de mégacôlon très éloignés des sources de la maladie, donc cette méthode semble trop optimiste. Dans le deuxième cas au contraire, le risque se propage sans diminution entre parents et enfants. Cela non plus ne semble pas réaliste, car alors les cas de mégacôlons seraient plus fréquents.
On peut donc en conclure que, dans la réalité, le risque ce situe quelque part entre ces deux extrêmes. Le parent doit probablement transmettre la maladie à un pourcentage se situant entre 50% et 100%. Ce qui fait que, dans notre exemple, Bidule a entre 1/4 et 1/16 d’avoir la maladie.
Le fait que la première méthode de calcul soit la plus couramment utilisée explique que des rats ont été autorisés de reproduction, car le risque paraissait infime, et que la maladie s’est déclarée malgré tout dans les portées suivantes. Cela prouve que cette méthode est trop optimiste, et qu’elle n’est pas réaliste.
Lorsqu’on regarde les portées touchées par le passé, on remarque que, quand une portée est touchée, ça ne concerne en général pas la moitié des ratons mais souvent la totalité. Surtout si les ratons portent des marquages à risque. En effet, on ne voit jamais de rat high white, né dans une portée malade, qui ne soit pas lui aussi touché par la maladie.
Regardons un autre cas concret, celui de la descendance d’AR Magnum. On trouve dans cette lignée des portées touchées par la maladie à la génération 3, 5, 6, 7, 11 et 13. Cela prouve que le mégacôlon peut se transmettre sur au moins 13 générations. Hors, selon la méthode de calcul 2, cela est presque impossible, puisque le risque après 13 générations est infime, et qu’en plus il faut un terrain favorable.
Ces observations renforcent l’hypothèse selon laquelle la probabilité qu’un rat transmette la maladie à ses enfants est plus proche de 100% que de 50%, comme on le pense communément.
Bien sûr, les deux méthodes de calcul sont très simples, et ne tiennent pas compte des autres facteurs, comme le terrain favorable du high white ou les autres maladies. La consanguinité devrait également influencer le calcul, car s'il y a un risque qu’à la fois la mère et le père transmette la maladie, le raton aura plus de risque de déclarer la maladie que si on ajoute tout les deux risques*. Ces facteurs sont très difficiles à quantifier.
C’est pourquoi on ne les entre pas dans le calcul de risque, mais on en tient compte lors du choix de faire reproduire ou non un rat. Il est ainsi couramment admis qu’un rat à bas risque, s’il n’est pas reproduit avec un rat high white, a peu de chances de voir la maladie se déclarer dans sa portée, et il est donc autorisé de reproduction.
Malheureusement, cette façon de procéder n’est pas suffisante pour éliminer le risque, puisque des portées on été touchées malgré ces précautions. Il apparaît donc nécessaire d’être plus radical dans les choix, si l’on veut réellement éradiquer cette maladie.
Prenons maintenant un exemple réel. Ici, on cherche à connaître le risque de Blue, afin de décider s’il est raisonnable de le faire reproduire ou non. Bélia a déclaré le mégacôlon, et Égérie est le nœud reliant Bélia à Blue. Pour information, les rats portant des étoiles sont des rats portant le gène high white.
 Cas réel : on cherche à déterminer le risque de Blue
Cas réel : on cherche à déterminer le risque de BlueEn appliquant la méthode de calcul 1, on obtient un risque pour Blue de 1/4096. En appliquant la méthode de calcul 2, on obtient un risque pour Blue de 1/64. Donc, si Blue reproduisait avec Blurp, qui, selon le premier calcul toujours, a un risque de 1/1024, on aurait 1 chance sur 819,2* que les ratons de cette portée soient malades. Selon le deuxième calcul, Blurp a un risque de 1/64, ce qui fait que les ratons auraient 1 chance sur 32 d’être malades, ce qui fait une énorme différence.
Si on suit le raisonnement précédent, le risque réel que cette future portée soit malade se situe donc quelque part entre 1 chance sur 819,2* et 1 chance sur 32.
Bien sûr, il est tout à fait possible ici que le mégacôlon qui a touché Bélia provienne de l’autre branche, celle d’Abba, et non celle de Jazz. Mais ce n’est qu’une hypothèse, et non une certitude. Le risque que la maladie soit présente dans la branche de Jazz existe.
Dans un cas comme celui-là, quelle est alors la meilleure décision à prendre ? La plus prudente, qui est de considérer que le risque est trop grand et que la portée devrait être annulée, ou choisir de ne pas tenir compte du risque qui, quelque soit le calcul, existe ?
3 - Méthodologie de recherche, explicationarticle destiné au grand publica - recherche
La recherche qui suit a été réalisé avec une méthodologie précise qui s'applique aux généalogies.
Il s'agit de partir d'un individu atteins puis de suivre les chemins qu'ont put emprunter les gènes malades.
Par exemple, les gènes malades ont pu venir de l'un ou l'autre des parents et donc des grands parents. Si les gènes viennent des grands-parents, ils peuvent avoir été transmit aux oncles et aux cousins de l'individu malade.
Le mégacolon pouvant ne pas apparaitre durant plusieurs générations avant de toucher un individu ou une famille, cette méthode a été employé sans limite de génération.
N'ayant pas une vue d'ensemble sur la généalogie avant de commencer la recherche, et notamment sur la consanguinité (même lointaine) qui a pu causer une transmission de la maladie, il a fallu étendre la recherche plus loin. C'est ainsi que des transmissions possible jusque là invisible ont pu se dévoiler. Le problème de cette extension a été l'ajout de rat non lié à la maladie, qui rend la recherche plus difficile à appréhender mais également bien plus complète.
L'ajout de ces rats n'est donc pas une erreur mais un parti-pris.
b - légende
en rouge : les rats ayant eut ou ayant pu transmettre le mégacolon. Il s'agit uniquement des ancêtres directs (parents, grand-parents, arrière-grand-parents, arrière-...-grand-parents) de portées malades.
4 - En France et en Belgiquearticle destiné aux rateries et aux adoptantsNous allons commencer par observer les portées malades puis leurs familles proches et les rats auxquelles ils ont pu transmettre les gènes de la maladie.
Shenza OKR X Patchouli RDW (?), France
Taz RTD X Bella RDW, France
Daïko RAT X Korrigan du Château
a - en partant de la portée de Daïko RAT et de Korrigan du ChâteauLa portée de Daïko RAT et de Korrigan du Château a été touché par la maladie du mégacôlon et est décédée.
La maladie a donc pu être transmise par Daïko RAT (et donc ses ancêtres) ou par Korrigan du Château (et donc ses ancêtres) qui sont donc inscrit en rouge dans les graphiques. Les gènes de la maladie ont pu également être transmit aux cousins (portée malade -> parent -> oncle -> cousin).
la famille proche :

la famille proche incluant les oncles et tantes de la portée ainsi que leurs descendants (cousin de la portée) :
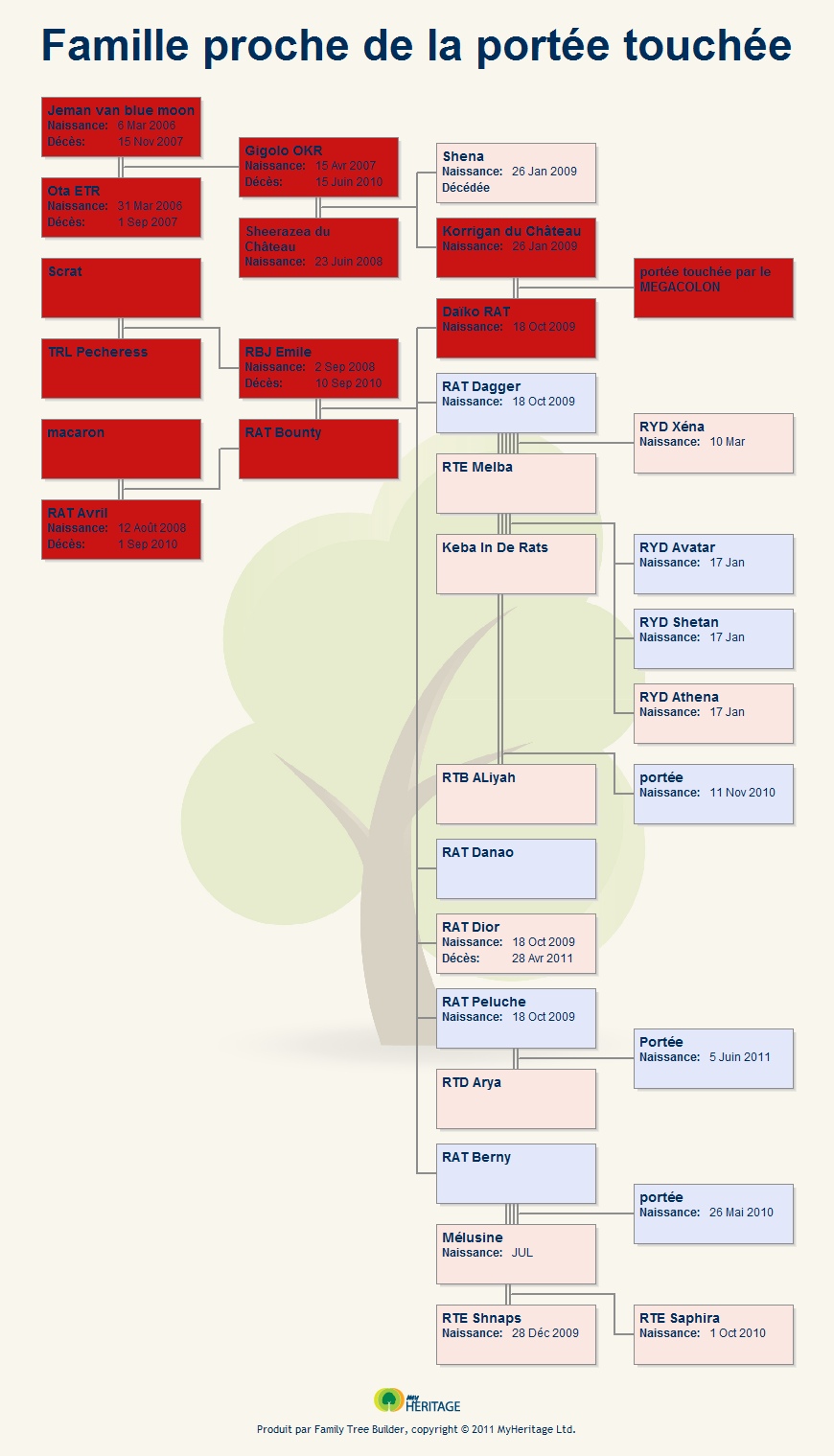
pour aller plus loin :
les ancêtres directs de Sheerazea :

Le père, Gigolo OKR est le fils de Ota qui vient de l'étranger (voir la partie 5). Nous nous étendrons sur ses ancêtres dans la partie 5 et sur ses frères et soeurs dans la partie 4-b.
les descendants de Gigolo :

Voici un graphique mettant en scène la famille proche de la portée touchée qui pourrait avoir reçut les gènes malades. Les lignées de Gigolo OKR étant très étendu, j'ai limité le nombre de génération sur ce graphique.

Un second point d'entrée en France a été formé par la portée de Pintor's Guizmo X Idole of Mirinja. Pintor's Guizmo est le descendant direct d'AR Magnum et d'AR Summer a 8 générations seulement.
les ancêtres de Pintor's Guizmo suivit de l'arbre des descendants :

Les portées touchées à l'étranger :
SRR Cole X SRR Corey, États-Unis, Kansas City, Missouri
Tail's Mr Fitness X Rozijntje van Silverstone, Nieuwegein, Pays-Bas
Arietje Animal's X Chenny, "noord holland", Pays-Bas
Fairy Tales' Djinn X Dona Siswai'aman Con Azurro, Pays-Bas
RSCL Magnusson X MAR Morgan, États-Unis, Washington
Khnum van het Muizenhuis X Horlepiep Delia, Pays-Bas
Neo van Ratten-Ri X Green Dream's Tsearke, Netherlands
Aristo's System X Lemon van Silverstone, Nieuwegein, Pays-Bas
Viola's Hamlet X G-Roosje van Ratten-Ri, Netherlands
Viola's Hymke X Ratranch Connor Casanova
Vermont van Ratten-ri X Stephanie's Chelsea
TRR Yukon Jack X SGR Gentle Melody
Sunshine's Bacardi Breezer X Beertje van de Risratjes
RG Dido X Horlepiep Bilbo
Kinki van Silvestone X ???
Astérix RG X Hasse van Saona
Note : A l'étranger, suivant les pays, la reproduction des rats est vu de façon différente. On trouve notamment des rats reproduisant beaucoup et depuis le plus jeune âge, de la consanguinité proche (parent / enfant) et parfois une absence de suivit total sur plusieurs générations. Toute fois, il ne faut pas stigmatiser les pays, il y a des bonnes et des mauvaises rateries dans chacun.
exemple de consanguinité "massive" :
 autre exemple de consanguinité élevé
autre exemple de consanguinité élevé :
Le principal point d'entrée en France des rats appartenant à la lignée pouvant transmettre le lien malade a été la portée de Ota X Jeman van Blue Moon. Néanmoins, ce n'est pas le seul point d'entrée possible, chaque importation de rat pouvant créer un point d'entré supplémentaire, c'est pourquoi la recherche a été étendu à l'étranger. Nous avons pu observer dans cette lignée de nombreux autres cas de mégacolon, relié par des ancêtres communs.
AR Magnum et AR Summer sont les ancêtres directs de nombreuses portées atteintes par la maladie.
arbre des ancêtres d'une portée touchée par le MC, à nombre de génération limité :

Observons cet exemple d'un point de vue d'apparence.
AR Magnum : Platinum blazed berkshire dumbo
AR Summer : Fawn self dumbo
AR Oshira : Amerikaans Blauw Berken Dumbo
Dagmar's Ivan 2 : Mink geblest berken odd-eye dumbo
Dagmar's Xi : Mock mink berken dumbo
Astérix RG : Zwart mismarked bareback met spot gladhaar dumbo drager
portée touchée par la maladie : Amerikaans blauw splitcapped japanner dumbo
exemple de descendants d'AR Magnum X AR summer n'ayant pas déclaré la maladie :

Observons le dernier exemple d'un point de vue d'apparence.
AR Magnum : Platinum blazed berkshire dumbo
AR Summer : Fawn self dumbo
AR Bingo : Pink eyed white dumbo
MRC Joey : Agouti berkshire dumbo
MRC Joey Too : Cinnamon Berkshire Dumbo
MRC PermaFrost : Blue Agouti Self Dumbo
IR PermaFrost's Unforgettable : American Blue Agouti Self Dumbo
Dans cette lignée les seuls marquages à risque ont été AR Magnum et AR Bingo, suite à quoi on observe des unis (self) et des berkshires. Celà ne montre donc pas une absence de transmission possible mais une absence d'apparition possible de la maladie. Il faudrait observer des descendants de cette lignée possédant le gène hightwith pour savoir si elle est réellement épargnée. Cependant, le risque existant, cette lignée a été travaillé avec de grand marquages (irish, berkshire, uni...), ce qui ne permet aucune vérification. Cette généalogie montre d'ailleurs une pratique devenue courante qui est de ne jamais travailler le hightwith en dehors de rares généalogies exemptes de la maladie, ce qui sous-entends accepter qu'elle se transmette et se répande.
6 - En chiffres...article destiné au grand publicLors de l'étude de cette généalogie, ont été recensé :
2171 rats
19 portées touchées par le mégacôlon




